Engpass bei den Benannten Stellen: Europas Herausforderung mit MDR und IVDR

Índice de contenidos
Index of contents
Index du contenu
Inhaltsverzeichnis
Indice dei contenuti
- Einführung: das Paradoxon einer steigenden Nachfrage bei begrenztem Angebot
- Regulatorische Erinnerung: MDR, IVDR und die Rolle der Benannten Stellen
- Ein paar Kennzahlen
- Der Wendepunkt: warum der Mangel an Benannten Stellen ein systemisches Risiko darstellt
- Prognosen: Was ist bis 2028 zu erwarten?
- Folgen für Hersteller und PRRC/QARA
- Wie kann diese Situation verbessert werden?
- Fazit: Der Countdown läuft
Einführung: das Paradoxon einer steigenden Nachfrage bei begrenztem Angebot
Mit dem Inkrafttreten der MDR und der IVDR müssen alle Hersteller von Medizinprodukten über Benannte Stellen (BS) gehen. Jedes Produkt oder jede Produktreihe muss gemäß der Verordnung zertifiziert werden, um auf den europäischen Markt in Verkehr gebracht werden zu können. Dennoch bleibt die Anzahl dieser benannten Stellen unzureichend, um den Ansturm der Anfragen zu bewältigen.
Regulatorische Erinnerung: MDR, IVDR und die Rolle der Benannten Stellen
— Die Verordnung (EU) 2017/745 (MDR), die am 26. Mai 2021 in Kraft trat, ersetzt die alten Richtlinien.
— Die Verordnung (EU) 2017/746 (IVDR) für In-vitro-Diagnostika tritt 2022 in Kraft.
— Die Benannten Stellen sind die befugten Einheiten, die Konformitätsbewertungen durchführen, insbesondere für Produkte mit hoher Risikoklassifizierung, die technische Dokumentation bewerten, Qualitätsmanagementsysteme auditieren usw.
Ein paar Kennzahlen
Laut MedTech Europe repräsentiert der Sektor von Medizinprodukten und In-vitro-Diagnostika in Europa :
- Rund 38.000 Unternehmen
- Mehr als 500.000 Produkte im Umlauf im Jahr 2025 (davon mindestens 80 % noch unter den europäischen Richtlinien 93/42/EWG und 98/79/EG)
Der Übergang zur MDR & IVDR
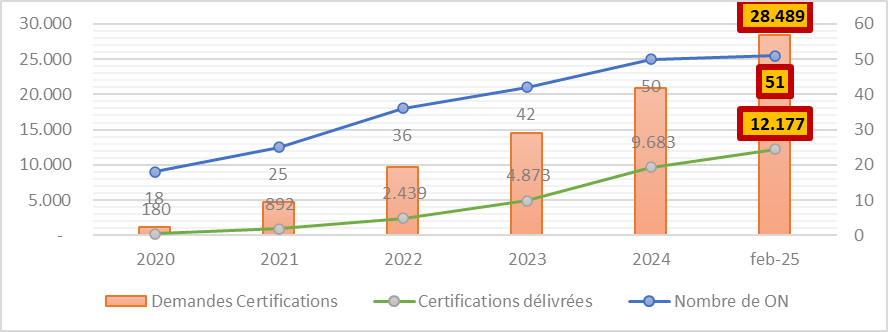
Laut den von der Europäischen Kommission veröffentlichten Daten stehen die 51 offiziellen Benannten Stellen im Februar 2025 vor der Aufgabe, rund 28.500 Zertifizierungsanträge zu bearbeiten. Zum gleichen Zeitpunkt wurden mehr als 12.000 Zertifikate erteilt, das entspricht 43 %.
Was Sie auch wissen sollten:
- Im Durchschnitt vergehen 13 bis 18 Monate, bis die technische Dokumentation (Dossier) im Rahmen des Konformitätsbewertungsverfahrens geprüft und das entsprechende Zertifikat von der Benannten Stelle ausgestellt wird.
- Unvollständige eingereichte Dokumentation verlängern diese Frist.
- Technische Dokumentation bzw. das Dossier kann abgelehnt werden und muss dann erneut eingereicht werden.
Der Wendepunkt: warum der Mangel an Benannten Stellen ein systemisches Risiko darstellt
— Engpässe: Die bestehenden BS sind mit Anfragen überlastet, ihre Ressourcen (Expertise, Auditoren) sind begrenzt.
— Erhöhte Komplexität der Vorschriften: Die MDR stellt strengere Anforderungen (klinisch, Überwachung nach dem Inverkehrbringen, mehr Dokumentation) als die Richtlinien, was die Arbeitsbelastung pro Dokumentation erhöht.
— Unvollständige oder schlecht vorbereitete Dokumentation: führt zu einem Verlust wertvoller Zeit für die BS und die Hersteller.
— Risiko eines Produktmangels auf dem europäischen Markt, wenn die Hersteller ihre Zertifizierung nicht rechtzeitig erhalten (Marktzugang verzögert). Eine der Motivationen für die Verlängerung der Übergangsfristen ist genau, diese Engpässe zu vermeiden.
— Der Zeitdruck steigt: Mit der geplanten Frist für die vollständige Zertifizierung bis 2028 wird die verfügbare Zeit für die Übergänge immer knapper.
Prognosen: Was ist bis 2028 zu erwarten?
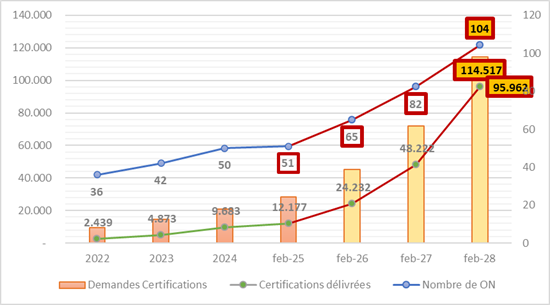
Prognose 1 : Basierend auf dem Tempo der Benennung von BS zwischen 2022 und 2025 könnte man hoffen, von derzeit 51 auf etwa 85 Benannte Stellen bis Ende 2027 und mehr als 100 im Jahr 2028 zu kommen. Aber das hängt stark vom politischen Willen, den nationalen Investitionen und den Akkreditierungskapazitäten ab.
Prognose 2 : Immer noch basierend auf den Entwicklungen seit 2022 würde die Anzahl der Anfragen mindestens 114.000 erreichen. Diese Zahl ist jedoch nicht relevant und sollte daher erheblich höher sein, da etwa 400.000 Produkte der 500.000 derzeit im Umlauf befindlichen unter die Verordnung fallen müssen. Und das trotz der möglichen Gruppierungen nach „ Produktfamilien “ (ansonsten 1 Produkt = 1 Dossier).
Prognose 3 : Gemäß dem aktuellen Zertifizierungstempo kann man schätzen, dass 95.000 Zertifikate bis 2028 ausgestellt werden. Das entspricht nicht einmal den 114.000 möglichen technischen Dokumentationen (Dossiers) im besten Fall.
Ergebnisse der Prognosen : Wenn die Zahl von 104 Benannten Stellen tatsächlich bis 2028 erreicht wird und auch die Anzahl der erteilten Zertifikate, würde das 919 Zertifizierungen pro BS bedeuten. Ist das machbar ?
Folgen für Hersteller und PRRC/QARA
Auf Seiten der verantwortlichen Personen zur Einhaltung der Regulierungsvorschriften ist der Druck spürbar. Die zuvor genannten verschiedenen Grenzen (Zeit, Budget, regulatorische Anforderungen usw.) verkomplizieren ihre Aufgaben, denn :
— Die Auswahl eines BS wird zu einer strategischen Herausforderung: Verfügbarkeit, Fristen, Kompetenz, Preisgestaltung, Spezialisierung nach Produkttyp.
— Eine proaktive Planung ist unerlässlich: frühzeitig mit der Vorbereitung der technischen Dokumentation beginnen, von Vorab-Audits profitieren, sicherstellen, dass die Dokumentation vollständig und konform ist.
— Es besteht das Risiko von Verzögerungen bei Markteinführungen: Ein fertiges Produkt muss auf die Bewertung der technischen Dokumentation durch das BS warten, um auf den Markt zu kommen.
— Sie müssen manchmal auf BS im Ausland zurückgreifen (Kosten, Logistik).
— Sie wissen um die Bedeutung der Stabilität der Partnerschaft mit dem BS, um Überwachungsaudits, Erneuerungen, Umfangsänderungen usw. zu planen.
Trotz der Bemühungen der verschiedenen Interessengruppen machen die Komplexität der Regulierungsvorschriften und der akute Mangel an BS die Aufgabe schwierig. Die Akteure des Sektors, einschließlich der BS selbst, appellieren regelmäßig an die Behörden, um auf strukturelle Mängel hinzuweisen und vor dem Engpass- und Mangel-Effekt zu warnen.
Wie kann diese Situation verbessert werden?
Natürlich gibt es kein Wundermittel, um die vorab beschriebenen Probleme zu beseitigen. Wenn Europa einen gravierenden Mangel an Medizinprodukten vermeiden will, muss es schnell handeln, insbesondere indem es die folgenden Vorschläge prüft:
— Die Mitgliedstaaten ermutigen, die Benennung zusätzlicher BS zu fördern und zu unterstützen.
— Einige Schritte des Bewertungsprozesses harmonisieren und vereinfachen, um die administrative Belastung zu verringern. ( Durch Überprüfung bestimmter Anforderungen?)
— Die Ausbildung von MDR/IVDR-Experten-Auditoren stärken, um den Pool verfügbarer Kompetenzen zu erweitern.
— Die Dokumentationsqualität der Hersteller sicherstellen, um unnötige Iterationen zu vermeiden. (Mit klaren und präzisen Erklärungen dessen, was erforderlich ist)
— Eine gesetzliche Antwortfrist für die BS festlegen ? — Die Zusammenarbeit zwischen BS, Behörden und Industrieverbänden fördern, um die Lasten besser zu verteilen
.
Fazit: Der Countdown läuft
Der Mangel an Benannten Stellen in Europa bleibt eines der Haupthindernisse für einen reibungslosen Übergang zu einem Markt, der vollständig den MDR/IVDR-Anfroderungen entspricht. Für die Hersteller ebenso wie für die PRRC/QARA erfordert diese Realität eine strenge, vorausschauende und widerstandsfähige Strategie. Wenn die Benennung neuer BS voranschreitet, muss sie mit einem realen Kapazitätsaufbau und einer erhöhten Effizienz einhergehen, um das Risiko einer allgemeinen Überlastung bis 2028 zu vermeiden.
Letzte aktualisierte Zahlen Oktober 2025 :
- Benannte Stellen für die Verordnung EU 2017/745 Medizinprodukte : 51
- Benannte Stellen für die Verordnung EU 2017/746 In-vitro-Diagnostika: 19
Quellen und Referenzen
- Europäische Kommission – Study supporting the monitoring of the availability of medical devices on the EU market, 2025.
https://health.ec.europa.eu/document/download/59b9d90e-be42-4895-9f6f-bec35138bb0a_en?filename=md_nb_survey_ - MedTech Europe – The European Medical Technology Industry in figures, 2025.
- Europäische Komission – NANDO (New Approach Notified and Designated Organisations ) Information System.
https://webgate.ec.europa.eu/single-market-compliance-space/notified-bodies
Vielleicht interessieren Sie sich auch für folgende Artikel:

Mit einer Ausbildung in Marketing und internationalem Handel hat Alex schon immer eine Vorliebe für Sprachen und ein Interesse an verschiedenen Kulturen gezeigt. Ursprünglich aus der Bretagne in Frankreich stammend, lebte er in Irland und Mexiko, bevor er eine Zeit lang nach Frankreich zurückkehrte und sich schließlich dauerhaft in Spanien niederließ. Er arbeitet als Chief Growth Officer bei AbroadLink Translations.



Neuen Kommentar hinzufügen